La douleur : décryptage et stratégies thérapeutiques à l'officine
En France, près de 30 % des adultes souffrent de douleurs chroniques, altérant leur qualité de vie et leur quotidien. Ce Grand Angle passe en revue la douleur, depuis ses mécanismes d'origine jusqu'aux stratégies thérapeutiques, avec un focus sur la prise en charge en officine. Qu'elle soit nociceptive, inflammatoire, neuropathique ou nociplastique, chaque type de douleur nécessite une approche adaptée. Le Dr Claire Debes, médecin anesthésiste-réanimateur à l'APHP, spécialisée dans la prise en charge de la douleur aiguë et chronique et responsable de l'UF d'évaluation et de traitement de la douleur de l'Hôpital Tenon, partage son expertise sur les avancées et la prise en charge en algologie.

- 1. La douleur : un phénomène complexe
- 2. La subjectivité de la douleur
- 3. Quels antalgiques utiliser ?
- 4. Les différents types de douleur
- a.La douleur nociceptive
- b.La douleur neuropathique
- c.La douleur inflammatoire
- d.La douleur nociplastique
- 5. Intolérance à la codéine et au tramadol : pourquoi ?
- 6. Réglementation de la codéine et du tramadol : un encadrement durci
- 7. Approche non médicamenteuse dans la prise en charge de la douleur
- 8. Quelles innovations à venir ?
La douleur : un phénomène complexe
La douleur est un phénomène sensoriel et émotionnel résultant de mécanismes neurophysiologiques complexes. Elle agit comme un signal protecteur du corps en réponse à une lésion réelle ou potentielle. L’IASP (International Association for the Study of Pain) souligne son caractère subjectif, influencé par des dimensions physiologiques, psychologiques et sociales. La douleur commence dans les nocicepteurs, des terminaisons nerveuses sensibles aux stimuli thermiques, chimiques ou mécaniques nocifs. Ces nocicepteurs, situés dans la peau, les muscles et les articulations, génèrent un potentiel d’action transmis par des fibres Aδ (rapides, pour une douleur aiguë) et C (lentes, pour une douleur diffuse). Les signaux douloureux atteignent la moelle épinière, où ils sont modulés par des neurotransmetteurs (glutamate, substance P) et inhibés par des mécanismes (GABA, glycine, endorphines). Ensuite, ils remontent au thalamus, puis au cortex somatosensoriel pour localiser la douleur, et au cortex cingulaire et à l’insula pour l’aspect émotionnel, tandis que le cortex préfrontal apporte une dimension cognitive et affective.
La subjectivité de la douleur
La douleur est une expérience profondément subjective, influencée par des dimensions sensorielles, émotionnelles et cognitives, comme l’explique le Docteur Claire Debes : « La douleur est une expérience subjective, influencée par des facteurs sensoriels, émotionnels et cognitifs. Actuellement, il n’existe pas de biomarqueurs spécifiques permettant de mesurer objectivement la douleur. » Cette nature subjective rend l’évaluation de la douleur complexe, d’autant plus que chaque individu interprète et décrit sa douleur différemment. Face à cette subjectivité, les cliniciens s’appuient sur des outils d’auto-évaluation et d’hétéro-évaluation pour estimer l’intensité de la douleur, en tenant compte des capacités de communication du patient. En auto-évaluation, l’Échelle Visuelle Analogique (EVA) et l’Échelle Numérique (EN) sont couramment utilisées : l’EVA, où le patient place sa douleur sur une ligne de 0 à 10 ou 0 à 100, est très précise mais parfois difficile pour certains patients, tandis que l’EN, avec une simple note de 0 à 10, est recommandée pour sa simplicité.
L’Échelle Verbale Simple (EVS), où le patient décrit sa douleur comme absente, faible, modérée ou intense, est utile pour ceux ayant des difficultés avec les chiffres. Pour les patients dont la communication est limitée, des outils d’hétéro-évaluation sont indispensables. « L’échelle des visages permet aux enfants de choisir un visage correspondant à leur douleur, tandis que l’Échelle Algoplus, développée pour les personnes âgées ayant des troubles de la communication, s’appuie sur l’observation de comportements pour estimer la douleur » explique le Docteur Claire Debes. La spécialiste insiste en précisant qu’il est « important d’évaluer la douleur dans sa globalité, l’intensité de la douleur étant surtout utile en douleur aiguë, mais beaucoup moins en douleur chronique ».
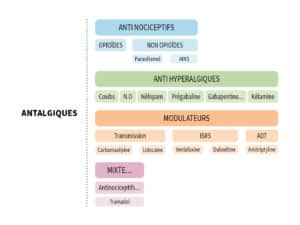
Quels antalgiques utiliser ?
Les recommandations pour l’utilisation des antalgiques sont désormais davantage basées sur le mécanisme de la douleur plutôt que sur son intensité. Comme le souligne le Dr Debes, « les paliers de l’OMS, bien qu’utiles pour les douleurs nociceptives pures, n’intègrent pas les spécificités des différents types de douleur ni leurs mécanismes. » Par exemple, pour une colique néphrétique, les AINS seront plus efficaces qu’un morphinique.
Aujourd’hui, la classification de Lussier et Beaulieu guide les traitements en fonction du mécanisme d’action des antalgiques, limitant les risques d’escalade thérapeutique et évitant l’association directe entre intensité de la douleur et classe d’antalgique. Pour les douleurs aiguës en ambulatoire, le choix entre paracétamol, AINS ou opioïdes légers comme la codéine et le tramadol repose sur des critères précis selon le type et le mécanisme de la douleur.
Les différents types de douleur
La douleur nociceptive
La douleur nociceptive, déclenchée par l’activation des nocicepteurs en réponse à une lésion tissulaire, implique la libération de médiateurs inflammatoires tels que la bradykinine, les prostaglandines et l’histamine, qui sensibilisent les fibres nerveuses. La prise en charge de cette douleur repose sur une sélection rigoureuse d’antalgiques, en fonction de l’intensité, de la durée du traitement, et du profil de tolérance du patient. Pour les douleurs aiguës, comme les douleurs musculaires, les maux de tête ou les douleurs osseuses, le Dr Debes recommande d’adapter le choix de l’antalgique en fonction de ces critères spécifiques.
- Paracétamol : « recommandé en première intention pour les douleurs légères à modérées, le paracétamol est choisi pour sa bonne tolérance et l’absence de risques gastro-intestinaux, même à dose élevée (3-4 g/jour). » En effet, il est souvent le premier antalgique à envisager pour une douleur aiguë.
- AINS : les AINS, comme l’ibuprofène et le kétoprofène, sont privilégiés pour les douleurs associées à une composante inflammatoire (ex. coliques néphrétiques, douleurs post-traumatiques). Toutefois, « ils doivent être prescrits avec prudence en raison de leurs effets secondaires gastro-intestinaux et rénaux », ajoute le Dr Debes. Leur utilisation est donc limitée en durée.
- Opioïdes faibles (codéine, tramadol) : en cas de douleurs modérées à intenses résistantes aux autres traitements, la codéine et le tramadol peuvent être utilisés. Cependant, ils présentent des risques d’effets indésirables, tels que sédation et constipation, et doivent être utilisés avec précaution en raison du risque de dépendance.
La douleur neuropathique
La douleur neuropathique résulte d’une lésion ou d’un dysfonctionnement du système nerveux central ou périphérique, et se manifeste fréquemment sous forme de brûlures, de dysesthésies (sensations anormales) ou d’allodynies (douleur au toucher léger). Cette douleur, souvent chronique, repose sur des mécanismes complexes, dont une sensibilisation centrale qui rend les neurones de la moelle hyperexcitables. Selon le Dr Debes, « les douleurs neuropathiques nécessitent des traitements spécifiques » pour cibler cette hypersensibilité.
Un outil de dépistage couramment utilisé pour identifier la douleur neuropathique est le questionnaire DN4, qui comporte dix questions. « Un score supérieur ou égal à 4/10 suggère une douleur neuropathique avérée, nécessitant un traitement anti-neuropathique », explique le Dr Debes. Au niveau périphérique, les lésions nerveuses peuvent également conduire à une repousse anormale des fibres nerveuses, formant des neuromes hypersensibles, avec une surexpression des canaux sodiques NaV1.7, NaV1.8 et NaV1.9, qui amplifie la transmission de signaux douloureux.
Le traitement de la douleur neuropathique requiert des options spécifiques, car les antalgiques classiques sont souvent inefficaces. Comme l’indique le Dr Debes, « l’algorithme thérapeutique recommande trois classes de médicaments » pour cette douleur :
- Antidépresseurs tricycliques (ATC) : utilisés à faible dose (5-25 mg), les ATC, comme l’amitriptyline, « sont efficaces pour moduler la douleur neuropathique sans avoir l’effet antidépresseur ». Ils agissent en augmentant la disponibilité de la sérotonine et de la noradrénaline dans les synapses, modulant ainsi la perception de la douleur.
- Inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSNA) : la duloxétine et la venlafaxine sont particulièrement efficaces à des doses adaptées à la douleur neuropathique. En augmentant les niveaux de sérotonine et de noradrénaline, ils renforcent l’inhibition de la douleur au niveau spinal.
- Anticonvulsivants : la gabapentine est souvent prescrite en première intention, tandis que la prégabaline est réservée en seconde intention. Comme le précise le Dr Debes, « la prégabaline est utilisée en cas de réponse insuffisante ou d’effets secondaires avec la gabapentine, mais son risque de mésusage et ses effets secondaires sont plus importants ».
Pour les douleurs neuropathiques réfractaires, les opioïdes comme les morphiniques ne sont indiqués qu’en troisième ligne en raison de leur efficacité limitée et des risques d’effets indésirables. Le tramadol, avec son action mixte (opioïde et inhibiteur de la recapture de la sérotonine), est recommandé en seconde ligne, mais son utilisation est de plus en plus restreinte en raison de son efficacité limitée et de son risque de mésusage.
La douleur inflammatoire
La douleur inflammatoire est une réponse du système immunitaire à une lésion tissulaire ou une infection, entraînant la libération de médiateurs pro-inflammatoires comme les prostaglandines, la bradykinine et des cytokines (IL-1, TNF-α). Elle se manifeste souvent par une douleur sourde, lancinante et pulsatile, amplifiée par le mouvement ou la pression, et peut également augmenter la sensibilité des nocicepteurs. Le processus inflammatoire déclenche une cascade biochimique, avec la libération de médiateurs qui activent les cellules immunitaires, augmentant ainsi la production de prostaglandines et de leucotriènes. Ces médiateurs abaissent le seuil d’activation des nocicepteurs via les enzymes COX-1 et COX-2, amplifiant la douleur et rendant les nocicepteurs plus sensibles aux stimuli.
Les options thérapeutiques pour la douleur inflammatoire incluent principalement les AINS et les corticostéroïdes, qui agissent en bloquant différentes étapes de la cascade inflammatoire :
- AINS : les AINS, comme l’ibuprofène, le kétoprofène et le diclofénac, inhibent les enzymes COX-1 et COX-2, réduisant la synthèse de prostaglandines pro-inflammatoires. Cette action diminue la sensibilisation des nocicepteurs et atténue les signes d’inflammation. Les AINS sélectifs pour COX-2, tels que le célécoxib, sont souvent préférés en cas de douleurs chroniques pour limiter les effets gastro-intestinaux.
- Corticostéroïdes : les corticoïdes (ex. prednisone, dexaméthasone) sont des anti-inflammatoires puissants qui inhibent la phospholipase A2, réduisant la production de prostaglandines et de leucotriènes. Ils exercent aussi une action immunosuppressive, limitant le recrutement des cellules inflammatoires. Cependant, leur usage prolongé est contrôlé en raison de risques tels que l’hyperglycémie et l’ostéoporose.
Dans les cas de douleurs inflammatoires sévères, notamment liées à des maladies auto-immunes, des traitements adjuvants comme les inhibiteurs de TNF-α (étanercept, infliximab) peuvent être envisagés.
Attention : les AINS sont formellement contre-indiqués au-delà de 24 semaines d’aménorrhée (5e mois), même en prise ponctuelle, en raison des risques graves pour le fœtus (atteintes rénales et cardio-pulmonaires). Avant ce terme, leur utilisation, surtout prolongée entre 12 et 24 semaines, est fortement déconseillée, car elle peut affecter la fonction rénale du fœtus.
La douleur nociplastique
La douleur nociplastique résulte d’un dysfonctionnement du traitement de la douleur au niveau du système nerveux central, sans lésion ni inflammation. Elle est souvent chronique et se manifeste par une hypersensibilité accrue aux stimuli, notamment dans des conditions comme la fibromyalgie et le syndrome de l’intestin irritable. L’hypersensibilisation centrale est un élément clé de cette douleur, impliquant une activation prolongée des récepteurs NMDA dans la moelle épinière et le cerveau, ce qui renforce la transmission de la douleur. Un dysfonctionnement des voies inhibitrices descendantes et une altération de la sérotonine et de la noradrénaline contribuent à l’hypersensibilité. La prise en charge de la douleur nociplastique s’aligne souvent sur celle de la douleur neuropathique.
Intolérance à la codéine et au tramadol : pourquoi ?
La réponse aux traitements antalgiques varie largement en fonction de facteurs génétiques, métaboliques, et même psychologiques. « Jusqu’à 20 à 30 % des patients peuvent présenter des effets indésirables notables en réponse à certains opioïdes, comme la codéine ou le tramadol, » explique le Dr Debes, ce qui nécessite une adaptation personnalisée des traitements. La codéine et le tramadol, par exemple, dépendent de l’enzyme CYP2D6 pour leur activation, et une variation génétique de cette enzyme peut influencer leur efficacité et leur tolérance. « Chez certains patients, ces médicaments ne sont pas convertis efficacement, entraînant une faible efficacité, tandis que d’autres les métabolisent trop rapidement, augmentant le risque d’effets indésirables, » ajoute-t-elle.
Pour les patients intolérants à ces opioïdes, plusieurs alternatives sont possibles :
- Néfopam : « le néfopam est une alternative intéressante pour les douleurs modérées à intenses, » souligne le Dr Debes. Cet antalgique non opioïde, peu variable en termes de métabolisme, offre un profil d’effets secondaires moins marqué. Actuellement disponible en intraveineuse et par voie orale, son AMM ne couvre que la douleur aiguë, notamment post-opératoire, mais il est déjà privilégié dans certains hôpitaux où le tramadol est absent des protocoles. L’arrivée de sa forme orale étend ainsi son utilisation.
- AINS et paracétamol : bien qu’ils soient limités aux douleurs inflammatoires ou légères à modérées, les AINS et le paracétamol peuvent être utilisés en combinaison ou en alternance selon le type de douleur et la tolérance du patient.
- Autres opioïdes : en cas d’échec avec la codéine et le tramadol, d’autres opioïdes comme l’oxycodone peuvent être envisagés. « Une évaluation minutieuse des risques de dépendance et d’effets indésirables est toutefois nécessaire, » rappelle le Dr Debes, surtout pour les douleurs chroniques.
- Traitements adjuvants : pour les douleurs neuropathiques ou mixtes, les adjuvants tels que les antidépresseurs tricycliques, les IRSNA (inhibiteurs de recapture de la sérotonine et de la noradrénaline), ou les anticonvulsivants comme la gabapentine et la prégabaline permettent de soulager la douleur sans recours aux opioïdes.
Réglementation de la codéine et du tramadol : un encadrement durci
Les récentes mesures réglementaires imposant une ordonnance pour la codéine et le tramadol depuis 2017, et l’exigence d’une ordonnance sécurisée à partir de mars 2025, visent à renforcer la sécurité d’utilisation de ces antalgiques. « Ces médicaments sont des dérivés morphiniques et présentent des risques de mésusage, de dépendance et d’effets indésirables, » rappelle le Dr Debes. L’obligation d’une ordonnance sécurisée est en effet une manière de souligner leur nature opioïde, encourageant une utilisation plus prudente et encadrée.
Loin de limiter l’accès aux traitements, cette mesure vise à protéger les patients en incitant les prescripteurs à évaluer attentivement les indications et à envisager des alternatives thérapeutiques, comme l’explique le Dr Debes : « Ces réglementations renforcent la sécurité des patients et encouragent une utilisation plus consciente et responsable de la codéine et du tramadol dans le cadre du traitement de la douleur. » Ce cadre plus strict nécessite toutefois un accompagnement des professionnels de santé pour expliquer les raisons de ces mesures et notamment les alternatives, dont l’arrivée du Néfopam par voie orale par exemple.
Approche non médicamenteuse dans la prise en charge de la douleur
Dans les centres antidouleurs, les approches non médicamenteuses jouent un rôle essentiel, apportant « une réelle valeur ajoutée en complément des traitements médicamenteux, notamment pour les douleurs neuropathiques localisées ou les douleurs chroniques rebelles, » explique le Dr Debes. La prise en charge est multidisciplinaire, intégrant des thérapies comportementales et cognitives pour aider les patients à gérer l’impact émotionnel de la douleur, en modifiant les pensées et comportements négatifs associés. Certaines techniques spécifiques, telles que l’EMDR et l’hypnothérapie, sont également utilisées pour favoriser la relaxation et réduire les symptômes. La kinésithérapie, indispensable pour traiter les douleurs musculo-squelettiques chroniques, aide aussi à prévenir la kinésiophobie (peur de bouger). Des séances d’éducation thérapeutique sont organisées pour que les patients développent des compétences de gestion quotidienne de leur douleur, limitant ainsi l’impact sur leur vie sociale et professionnelle. Les centres antidouleurs proposent également des techniques ciblées pour les douleurs neuropathiques, comme la stimulation transcutanée (TENS) et les injections de toxine botulique, ainsi que des interventions complémentaires telles que l’ostéopathie et les bilans posturaux, pour une prise en charge globale et personnalisée.
Quelles innovations à venir ?
Des avancées significatives sont en cours pour améliorer la gestion de la douleur, avec de nouvelles approches prometteuses. Parmi elles, la Stimulation Magnétique Transcrânienne Répétitive (rTMS) suscite un intérêt croissant : « cette technique non invasive utilise des impulsions magnétiques pour moduler l’activité cérébrale et a montré des résultats prometteurs dans le traitement des douleurs neuropathiques réfractaires, » explique le Dr Debes. Toutefois, en France, la rTMS n’est pas encore reconnue pour cette indication, limitant son accessibilité et sa prise en charge par l’Assurance Maladie. La neurostimulation médullaire représente une autre avancée, avec un dispositif implanté qui envoie des impulsions électriques à la moelle épinière pour atténuer la perception de la douleur, particulièrement pour les douleurs chroniques rebelles. « Bien que cette technique soit en cours d’évaluation, elle est déjà intégrée dans certaines recommandations thérapeutiques, » souligne le Dr Debes.
Des techniques comme la radiofréquence et la cryothérapie offrent également des options moins invasives pour moduler les nerfs responsables de la transmission de la douleur, offrant un soulagement durable pour certaines douleurs chroniques. Enfin, pour les migraines, des thérapies innovantes telles que les anticorps monoclonaux ciblant le peptide CGRP ont été développées pour la prévention. Cependant, « leur remboursement reste limité, ce qui restreint leur accessibilité pour de nombreux patients, » précise le Dr Debes, montrant que le défi de l’accessibilité demeure pour ces traitements innovants.