Obésité : l'officine en première ligne, accompagnement et conseils sur mesure
L'obésité, qui touche aujourd'hui plus d'un milliard de personnes dans le monde, est devenue une priorité de santé publique. En France, sa prévalence a doublé en 25 ans, atteignant 17 % de la population adulte. Face à cette épidémie, les traitements évoluent, notamment avec les agonistes des récepteurs GLP-1, qui bousculent la prise en charge. Au-delà du rôle de dispensateur, le pharmacien devient un acteur clé du suivi des patients, en assurant une éducation thérapeutique, une vigilance face aux effets secondaires et une coordination avec les autres professionnels de santé. Cependant, entre espoirs et limites, sa place mérite d'être redéfinie pour optimiser la prise en charge de l'obésité en officine, tout en garantissant un accompagnement global et individualisé.
Qu’est-ce que l’obésité ?
L’obésité est définie par l’OMS comme une accumulation excessive de masse grasse ayant des conséquences délétères sur la santé. Reconnue comme une maladie chronique depuis 1997, elle constitue aujourd’hui l’affection nutritionnelle la plus répandue dans le monde, avec un impact majeur sur la santé publique et l’économie. Multifactorielle, elle résulte d’un déséquilibre entre les apports énergétiques et les dépenses, mais son origine est également influencée par des facteurs génétiques, environnementaux et comportementaux. Contrairement à d’autres pathologies, elle ne peut être résolue par un « traitement court » : sa prise en charge nécessite un suivi prolongé et une approche globale.
Le Collège des Enseignants d’Endocrinologie, Diabète et Maladies Métaboliques (CEEDM) estime qu’un taux de masse grasse optimal se situe entre 10 et 15 % chez l’homme adulte et entre 20 et 25 % chez la femme. Toutefois, l’évaluation précise de cette masse grasse étant complexe, l’IMC est couramment utilisé en pratique clinique comme indicateur. Il se calcule en divisant le poids par le carré de la taille.
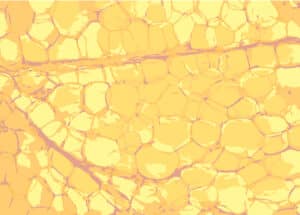
Adipocytes humains visualisés sur coupe de paraffine
Un IMC supérieur à 30 kg/m² est le seuil retenu pour définir l’obésité.
Il existe plusieurs types d’obésité, dont l’obésité androïde, caractérisée par une accumulation de graisse au niveau abdominal, et l’obésité gynoïde, où les graisses sont principalement stockées au niveau des cuisses et des hanches. Ces différences morphologiques influencent les risques métaboliques associés, notamment les maladies cardiovasculaires et le DT 2. Au-delà des complications médicales, l’obésité a également un impact social et psychologique significatif, contribuant à la stigmatisation et à des troubles de l’image corporelle.
Quelle prévalence ?
L’obésité a atteint des proportions épidémiques à l’échelle mondiale, comme le souligne l’OMS. Depuis 1975, sa prévalence a presque triplé. En 2016, plus de 1,9 milliard d’adultes étaient en surpoids, parmi lesquels 650 millions souffraient d’obésité. Cela représente environ 13 % de la population mondiale adulte.
En France, la situation est tout aussi préoccupante. Près de 17 % des adultes sont obèses, avec une forte disparité régionale : dans le Nord et l’Est du pays, cette prévalence atteint jusqu’à 30 %. Les données les plus récentes de l’Étude nationale nutrition santé (ENNS) indiquent que la progression est continue, notamment chez les jeunes adultes.
Chez les enfants et les adolescents, les chiffres sont également alarmants. Entre 2006 et 2017, la prévalence de l’obésité chez les 6 à 17 ans est passée de 3,3 % à 5,6 %. Les causes incluent une augmentation de la consommation de snacks sucrés et salés, une réduction de l’activité physique, et l’exposition croissante à des écrans, souvent associée à un grignotage régulier. Ces tendances préfigurent un accroissement des comorbidités métaboliques à un âge précoce.
Physiopathologie de l’obésité
L’obésité est une pathologie chronique et multifactorielle résultant d’un déséquilibre prolongé entre l’apport calorique et la dépense énergétique. Cette maladie, loin de se résumer à une simple accumulation de masse grasse, repose sur une physiopathologie complexe impliquant divers mécanismes hormonaux, métaboliques et inflammatoires.
Phases évolutives de l’obésité
L’obésité suit un processus évolutif en plusieurs étapes :
Phase de constitution
Cette phase est marquée par un excès d’apport énergétique par rapport à la dépense. Ce déséquilibre entraîne une augmentation du tissu adipeux (notamment sous-cutané), ainsi qu’une augmentation de la masse maigre (muscles et organes), ce qui modifie le métabolisme de base et favorise l’accumulation lipidique.
Phase d’entretien
À ce stade, l’organisme s’adapte à la surcharge pondérale et stabilise ses apports et ses dépenses énergétiques. Cependant, la capacité de stockage du tissu adipeux augmente, favorisant l’hypertrophie des adipocytes (augmentation du volume cellulaire) et la mobilisation de pré-adipocytes qui se différencient en adipocytes matures (hyperplasie adipocytaire). Cette phase est critique, car elle favorise la pérennité de l’obésité et la résistance aux efforts de perte de poids.
Phase de complications et de fluctuations pondérales
Cette étape est marquée par la survenue de comorbidités métaboliques (DT 2, insulinorésistance, stéatose hépatique non alcoolique, hypertension artérielle, syndrome d’apnée du sommeil) et cardiovasculaires (athérosclérose, infarctus du myocarde). On observe également des variations pondérales fréquentes, favorisant un phénomène d’effet rebond et d’aggravation des complications.
Le tissu adipeux : un acteur endocrinien central
Le tissu adipeux, loin d’être un simple réservoir énergétique, joue un rôle clé dans la régulation du métabolisme et de l’homéostasie énergétique.
Il sécrète plusieurs hormones et cytokines, appelées adipokines, qui agissent sur différents organes cibles :
- La leptine : cette hormone régule l’appétit et la dépense énergétique en agissant sur l’hypothalamus. Dans l’obésité, on observe une résistance à la leptine, limitant son effet anorexigène (coupe-faim) et favorisant un cercle vicieux de surconsommation calorique.
- L’adiponectine : cette adipokine a un rôle protecteur en augmentant la sensibilité à l’insuline, en inhibant la néoglucogenèse hépatique et en réduisant l’inflammation. Dans l’obésité, le taux d’adiponectine diminue, contribuant ainsi à l’apparition de troubles métaboliques tels que l’insulinorésistance et le diabète de type 2.
- Cytokines pro-inflammatoires (TNF-α, IL-6) : ces médiateurs favorisent un état inflammatoire chronique, augmentant le risque de complications cardiovasculaires et métaboliques. Le TNF-α, par exemple, perturbe la signalisation de l’insuline, favorisant l’insulinorésistance.
Impact sur le métabolisme glucidique et lipidique
L’obésité est fréquemment associée à des désordres métaboliques majeurs, tels que l’insulinorésistance. Cette dernière résulte d’une inflammation chronique et d’une perturbation de la signalisation de l’insuline au niveau cellulaire. L’excès de masse grasse viscérale est particulièrement impliqué dans cette résistance insulinique, augmentant le risque de développer un diabète de type 2.
Par ailleurs, l’accumulation de graisses au niveau des organes (foie, cœur, pancréas) entraîne des troubles du métabolisme lipidique, avec une augmentation des triglycérides et une baisse du cholestérol HDL. Ce profil lipidique athérogène accroît le risque d’athérosclérose et d’événements cardiovasculaires, tels que l’infarctus du myocarde et les accidents vasculaires cérébraux.
Conséquences sur le système endocrinien et pharmacologie
L’obésité modifie également l’action des médicaments, notamment par une altération de la pharmacocinétique (absorption, distribution, métabolisme et élimination). Par exemple :
- Distribution des médicaments : l’augmentation de la masse grasse modifie le volume de distribution des médicaments lipophiles, nécessitant des ajustements posologiques.
- Métabolisme hépatique : l’accumulation de graisse dans le foie (stéatose hépatique) peut altérer le métabolisme des médicaments hépatodépendants, influençant ainsi leur efficacité et leur toxicité.
- Élimination rénale : l’obésité peut également modifier le débit de filtration glomérulaire, impactant l’élimination des médicaments hydrosolubles.
Ainsi, la prise en charge pharmacologique de l’obésité doit être adaptée au profil métabolique et aux comorbidités du patient, avec une vigilance accrue sur les interactions médicamenteuses et l’efficacité thérapeutique. Cette complexité souligne l’importance d’une approche globale, impliquant à la fois une gestion nutritionnelle, une activité physique régulière et une prise en charge médicale et pharmaceutique optimisée.
Facteurs contributifs
L’obésité est une maladie multifactorielle résultant d’une interaction complexe entre des facteurs génétiques, métaboliques, environnementaux et psychologiques.
Facteurs génétiques et épigénétiques
La susceptibilité génétique à l’obésité n’est pas un mythe ; au contraire, elle est bien documentée. Si aucun gène unique ne détermine l’apparition de la maladie, des études ont identifié plus de 250 loci génétiques impliqués dans la régulation du poids corporel, notamment le gène FTO (Fat mass and obesity-associated gene), qui joue un rôle dans la régulation de l’appétit et du métabolisme énergétique. Ces polymorphismes peuvent influencer la signalisation hormonale, en altérant par exemple la réponse à l’insuline ou la sensibilité aux signaux de satiété.
L’hérédité est également un facteur clé : 70 % des personnes obèses ont au moins un parent atteint, suggérant un lien familial important. Cependant, l’influence génétique est modulée par des facteurs environnementaux, notamment via des mécanismes épigénétiques. Des modifications dans l’expression des gènes, influencées par l’alimentation maternelle pendant la grossesse, le stress ou encore l’exposition à certains polluants, peuvent programmer l’organisme dès la vie fœtale et prédisposer au développement d’un excès de poids à l’âge adulte.
Déséquilibre entre apports et dépenses énergétiques
L’obésité résulte d’un déséquilibre chronique entre les apports caloriques et la dépense énergétique. Cet excès calorique peut être favorisé par :
L’hyperphagie prandiale
Une augmentation excessive de la quantité de nourriture consommée lors des repas, souvent influencée par des habitudes alimentaires, des conditions socio-professionnelles ou encore une mauvaise régulation hormonale.
L’hyperphagie extra-prandiale
Caractérisée par des grignotages répétés, souvent en réponse au stress ou à des troubles psychologiques.
Outre les apports, la dépense énergétique joue un rôle fondamental. Elle repose sur trois éléments :
- La dépense énergétique au repos : qui varie en fonction de l’âge, du sexe et de la masse musculaire.
- La thermogenèse postprandiale : la dépense d’énergie liée à la digestion des aliments.
- L’activité physique : qui inclut à la fois l’exercice volontaire et les mouvements involontaires du quotidien.
Chez les personnes obèses, la dépense énergétique peut être inférieure à celle d’une personne de poids normal, notamment en raison d’une diminution de la masse musculaire et d’une moindre efficacité métabolique.
Facteurs environnementaux et sociaux
L’évolution des modes de vie a contribué à l’augmentation de l’obésité. Plusieurs facteurs favorisent un environnement obésogène :
- Sédentarité : la réduction de l’activité physique au profit d’un mode de vie plus statique (travail de bureau, temps d’écran prolongé) limite les dépenses énergétiques.
- Modification des habitudes alimentaires : la consommation accrue d’aliments ultra-transformés riches en sucres raffinés et en graisses saturées augmente l’apport calorique tout en modifiant la régulation de la satiété.
- Disponibilité et marketing alimentaire : la facilité d’accès à des produits hypercaloriques à faible coût, combinée à des stratégies de marketing agressives, incite à une surconsommation.
Les inégalités sociales sont aussi un facteur déterminant : les populations les plus précaires sont davantage touchées par l’obésité, en raison d’un accès limité à une alimentation équilibrée et à des infrastructures favorisant l’activité physique.
Influence endocrinienne et métabolique
Si les hormones impliquées dans la régulation de l’appétit ont été abordées plus haut, d’autres mécanismes endocriniens contribuent à l’obésité :
- Hyperinsulinémie et résistance à l’insuline : en présence d’un excès de graisse viscérale, les cellules deviennent moins sensibles à l’insuline, entraînant une hyperinsulinémie compensatoire qui favorise la lipogenèse et le stockage adipeux.
- Rôle du cortisol : le stress chronique induit une sécrétion prolongée de cortisol, qui stimule l’appétit et favorise l’accumulation de graisse abdominale.
- Altération du microbiote intestinal : une dysbiose intestinale, caractérisée par un déséquilibre des bactéries du microbiote, peut influencer l’absorption des nutriments et favoriser une inflammation de bas grade contribuant à l’obésité et aux troubles métaboliques associés.
Facteurs psychologiques et comportementaux
L’impact des troubles psychologiques sur l’obésité est majeur. Les troubles anxieux, la dépression et les troubles du comportement alimentaire (TCA) tels que l’hyperphagie boulimique sont fréquemment associés à une prise de poids. Ces pathologies altèrent la perception de la faim et de la satiété, favorisant des prises alimentaires compulsives ou émotionnelles.
Le stress chronique, en plus de son effet sur la sécrétion de cortisol, perturbe les circuits neuronaux de la récompense, rendant les aliments riches en sucres et en graisses particulièrement attractifs.
Conséquences métaboliques
L’obésité entraîne des perturbations métaboliques complexes, influençant la régulation hormonale, l’inflammation systémique et le fonctionnement de nombreux organes, en particulier dans l’obésité viscérale.
Inflammation systémique et insulinorésistance
L’hypertrophie des adipocytes favorise la sécrétion de cytokines pro-inflammatoires (TNF-α, IL-6), maintenant un état inflammatoire chronique. Ce phénomène contribue à :
- L’insulinorésistance : inhibition de la signalisation de l’insuline par interférence avec l’IRS-1, réduisant l’absorption du glucose.
- L’athérosclérose : stimulation de la formation de plaques d’athérome via l’oxydation des LDL et la dysfonction endothéliale.
Parallèlement, la diminution de l’adiponectine, hormone aux effets anti-inflammatoires et protecteurs, aggrave ces troubles métaboliques.
DT 2 et syndrome métabolique
L’obésité, notamment viscérale, est un facteur clé du diabète de type 2 (DT2), présent chez 80 % des diabétiques. Ses mécanismes incluent :
- Lipotoxicité : les acides gras libres altèrent la signalisation de l’insuline et inhibent GLUT-4 dans les muscles.
- Dysfonction pancréatique : l’exposition prolongée au glucose et aux acides gras induit l’apoptose des cellules β.
- Syndrome métabolique : association d’insulinorésistance, dyslipidémie, hypertension et obésité abdominale, augmentant le risque cardiovasculaire.
Dyslipidémie et complications cardiovasculaires
L’obésité modifie le métabolisme lipidique :
- Hypertriglycéridémie via une production excessive de VLDL.
- Diminution du HDL-cholestérol, réduisant la clairance des LDL.
- Accumulation hépatique des lipides, favorisant la stéatohépatite non alcoolique (NASH) et la fibrose hépatique.
L’hypertension artérielle, fréquente dans l’obésité, est liée à l’activation du SRAA, la rétention hydrosodée et l’hyperinsulinémie.
Morbidité et mortalité accrues
L’obésité augmente de 20 à 40 % le risque de mortalité, principalement par complications cardiovasculaires. Les mécanismes incluent :
- Hypertrophie ventriculaire gauche, favorisant l’insuffisance cardiaque.
- Athérosclérose accélérée, majorant le risque d’infarctus du myocarde.
- Hausse de 5 % du risque d’AVC par augmentation d’IMC de 1 kg/m².
Impact ostéo-articulaire et respiratoire
L’excès pondéral surcharge les articulations, favorisant gonarthrose et coxarthrose. La leptine, en excès, accélère la dégradation du cartilage.
Sur le plan respiratoire, l’obésité hypoventilation syndrome (OHS) et le syndrome d’apnée du sommeil (SAS) sont fréquents :
- Réduction du volume pulmonaire, limitant l’efficacité ventilatoire.
- Hypoxémie nocturne, augmentant le risque cardiovasculaire.
- Hypertension pulmonaire, évoluant vers une insuffisance cardiaque droite.
Risque oncologique et déséquilibres hormonaux
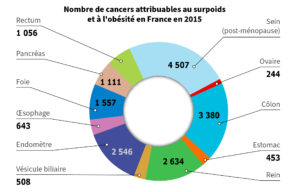
Salaün, Hélène, Juliette Thariat, Marina Vignot, Yacine Merrouche, et Stéphane Vignot. « Obésité et cancer ». Bulletin du Cancer 104, no 1 (1 janvier 2017): 30-41.
L’obésité accroît le risque de 13 cancers, notamment du sein, du côlon et de l’endomètre, via :
- Hyperinsulinémie et IGF-1, favorisant la prolifération cellulaire.
- Excès d’œstrogènes, issus de l’aromatisation (conversion chimique) des androgènes dans le tissu adipeux.
- Inflammation chronique, créant un microenvironnement tumoral favorable.
L’impact métabolique global de l’obésité en fait une pathologie nécessitant une prise en charge précoce et multidisciplinaire pour limiter ses complications.
Quelle prise en charge ?
La prise en charge de l’obésité repose sur une approche globale et individualisée, visant à limiter les complications associées et à améliorer la qualité de vie du patient. Elle débute par une évaluation complète, incluant la mesure de l’IMC et l’analyse des facteurs de risque métaboliques et cardiovasculaires. Cette première étape permet d’établir un état des lieux de la situation du patient, en prenant en compte son mode de vie, son environnement socio-professionnel et ses antécédents médicaux.
L’identification des comorbidités est primordiale : DT 2, hypertension artérielle, dyslipidémie, syndrome d’apnée du sommeil, troubles musculo-squelettiques… En parallèle, une évaluation du niveau d’activité physique, des habitudes alimentaires, et de l’impact psychologique de la maladie est nécessaire.
Objectifs et stratégies
La prise en charge vise principalement :
- Une stabilisation du poids ou une réduction pondérale en cas d’obésité ou de complications associées.
- Une diminution du tour de taille, indicateur clé du risque cardiométabolique.
- Une amélioration des paramètres métaboliques (glycémie, profil lipidique, pression artérielle).
- Les recommandations actuelles préconisent une perte de poids de 5 à 15 % en fonction du profil du patient.
Une perte de 5 à 10 % est déjà associée à des bénéfices significatifs, tels qu’une amélioration de la sensibilité à l’insuline, une réduction du risque de diabète, une baisse de la pression artérielle et une diminution des douleurs articulaires liées à la surcharge pondérale.
Approches thérapeutiques
La prise en charge repose sur plusieurs axes :
Modifications du mode de vie
- Rééquilibrage alimentaire : mise en place d’une alimentation adaptée, visant à réduire les excès caloriques sans induire de frustration.
- Augmentation de l’activité physique : adaptée aux capacités du patient, elle inclut une activité d’endurance et du renforcement musculaire pour optimiser la dépense énergétique.
Suivi médical régulier
- Chez l’adulte : consultations toutes les 4 à 6 semaines au début, puis un suivi annuel des comorbidités.
- Chez l’enfant : au moins un suivi tous les deux mois, en raison du risque de persistance de l’obésité à l’âge adulte.
Accompagnement psychologique
Indispensable en cas de trouble du comportement alimentaire ou d’impact psychologique majeur.
Possibilité de prise en charge par un psychologue ou un psychiatre, en complément du suivi médical.
Traitement médicamenteux et interventions spécifiques
L’utilisation de médicaments anti-obésité (comme les agonistes des récepteurs GLP-1) peut être envisagée chez certains patients présentant un IMC élevé et des comorbidités.
La chirurgie bariatrique (sleeve gastrectomie, bypass gastrique) est réservée aux cas d’obésité sévère (IMC ≥ 40 kg/m² ou ≥ 35 kg/m² avec comorbidités), lorsque les autres stratégies ont échoué.
Traitement per os : Orlistat (Xenical®)
L’Orlistat est un inhibiteur des lipases gastro-intestinales réduisant l’absorption des graisses alimentaires d’environ 30 %. Il est indiqué en complément d’un régime hypocalorique chez les patients avec IMC ≥ 30 kg/m² ou ≥ 28 kg/m² avec comorbidités.
- Mécanisme d’action : inhibe l’hydrolyse des triglycérides alimentaires en acides gras libres et monoglycérides, limitant leur absorption intestinale.
- Effets indésirables : troubles gastro-intestinaux fréquents (stéatorrhée, flatulences, incontinence fécale), atténués par un régime pauvre en graisses.
- Précautions : risque de carence en vitamines liposolubles (A, D, E, K), nécessitant une supplémentation. Contre-indication : en cas de malabsorption chronique ou de cholestase.
Agonistes des récepteurs GLP-1 : la nouvelle approche thérapeutique
Depuis la découverte du rôle clé des incrétines dans la régulation de l’appétit et du métabolisme glucidique, les agonistes des récepteurs GLP-1 se sont imposés comme une avancée majeure dans la prise en charge de l’obésité. Initialement développés pour le DT 2, ces traitements ont rapidement montré un impact significatif sur la perte pondérale, au point de devenir une option thérapeutique à part entière pour les patients en situation d’excès de poids.
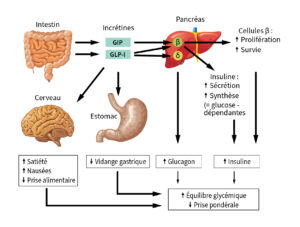
d’après la Revue Médicale SuisseLe GLP-1, hormone intestinale libérée en réponse à l’ingestion d’aliments, stimule la sécrétion d’insuline tout en inhibant celle du glucagon. Il ralentit également la vidange gastrique et envoie au cerveau un signal de satiété, réduisant ainsi l’apport calorique. Les agonistes du GLP-1 reproduisent ces effets de manière prolongée, tout en bénéficiant d’une stabilité accrue grâce à leur résistance à la dégradation enzymatique. Leur action ne se limite pas à la perte de poids : ils ont également démontré des bénéfices cardiovasculaires en réduisant l’inflammation et en améliorant les paramètres métaboliques.
Liraglutide (Saxenda®)
Parmi ces molécules, le liraglutide a été le premier à obtenir une autorisation de mise sur le marché pour l’obésité. Administré quotidiennement par injection SC, il agit principalement sur la régulation de l’appétit et la vidange gastrique. Son efficacité repose sur plusieurs mécanismes :
- il augmente la sécrétion d’insuline glucose-dépendante,
- il réduit la production de glucagon postprandial,
- il agit directement sur l’hypothalamus, modulant les circuits neuronaux impliqués dans la satiété.
Avec une perte de poids moyenne de 8 à 10 % après un an de traitement, Saxenda® a ouvert la voie aux traitements pharmacologiques modernes de l’obésité. Cependant, ses contraintes d’administration quotidienne et ses effets indésirables fréquents, notamment les nausées et troubles digestifs, ont limité son adoption à grande échelle. Son utilisation est réservée aux patients présentant un IMC ≥ 30 kg/m² ou ≥ 27 kg/m² en présence de comorbidités telles que le diabète, l’hypertension ou le syndrome d’apnées du sommeil.
Sémaglutide (Wegovy®)
Le sémaglutide, dernière innovation en date, a marqué une avancée majeure par rapport au liraglutide. Son principal atout ? Une administration hebdomadaire, qui améliore considérablement l’observance du traitement. Son action est plus prolongée et plus puissante : il potentialise l’effet incrétine huit fois plus intensément que la sécrétion naturelle de GLP-1, ralentit davantage la vidange gastrique et agit de façon plus marquée sur les centres de la satiété dans le cerveau. Les études cliniques STEP ont démontré des résultats impressionnants, avec une perte de poids atteignant 15 % en moyenne après 68 semaines. De plus, Wegovy® a montré un effet bénéfique sur la prévention des événements cardiovasculaires chez les patients en surpoids, un argument de poids pour son éventuel remboursement en France.
Cependant, son accès a connu une période de transition : après avoir bénéficié d’une autorisation d’accès précoce dès 2022, Wegovy® a officiellement été lancé en France en octobre 2024 et est désormais pleinement disponible en pharmacie. Si les négociations relatives à son remboursement par l’Assurance maladie sont toujours en cours, cela n’affecte toutefois pas sa disponibilité actuelle pour les patients. Sa prescription implique une vigilance particulière, notamment sur les éventuels effets digestifs ou en cas de rétinopathie diabétique.
Tirzépatide (Mounjaro®)
Le tirzépatide (Mounjaro®), est un médicament injectable administré une fois par semaine pour le traitement du DT 2 et la gestion du poids. La posologie initiale recommandée est de 2,5 mg par semaine pendant les quatre premières semaines. Par la suite, la dose est augmentée à 5 mg une fois par semaine. Si nécessaire, des augmentations supplémentaires peuvent être effectuées par paliers de 2,5 mg, avec un minimum de quatre semaines entre chaque palier, jusqu’à une dose maximale de 15 mg par semaine. Mounjaro® est disponible en stylos préremplis KwikPen contenant chacun quatre doses. Les sites d’injection recommandés sont l’abdomen, la cuisse ou le haut du bras, en variant les sites à chaque administration. L’injection peut être réalisée indépendamment des repas et à tout moment de la journée.
Des traitements révolutionnaires, mais sous surveillance
Si les agonistes du GLP-1 ont transformé la prise en charge de l’obésité, ils ne sont pas exempts d’interrogations. Des études sont en cours pour évaluer un risque potentiel de cancer médullaire de la thyroïde, tandis que certains patients ont signalé des altérations du comportement alimentaire et des pensées suicidaires sous traitement.
Et les compléments alimentaires ?
Dans la prise en charge du poids, le pharmacien peut s’appuyer sur certains compléments alimentaires tout en restant vigilant sur les contre-indications et interactions médicamenteuses. Des plantes diurétiques, comme le cassis et le pissenlit (présentes dans le produit Thermoxyl® de NHCO), sont parfois proposées pour leur effet drainant et brûle-graisses supposé, bien que les données scientifiques sur ce point restent limitées. Par ailleurs, des extraits riches en caféine (thé, café, maté, guarana) contribuent à la thermogénèse et à la lipolyse, mais l’ANSES recommande de ne pas dépasser 300 mg par jour et d’évaluer les risques d’interactions, comme avec les fluoroquinolones. De plus, le thé peut réduire l’absorption du fer. Côté fibres, le konjac est souvent mis en avant pour son effet « coupe-faim » lié à sa capacité à gonfler au contact de l’eau, mais une attention particulière est requise avec les médicaments à marge thérapeutique étroite (comme la carbamazépine ou les hormones thyroïdiennes). Enfin, l’ANSM souligne l’absence d’efficacité des plantes veinotoniques (marron d’inde, vigne rouge) dans la perte de poids et met en garde contre leur utilisation à cette fin. L’accompagnement du patient doit donc être individualisé et reposer sur une évaluation globale de sa situation, afin de sécuriser et d’optimiser le recours à ces produits en officine.