Nouvelles conditions de délivrance des médicaments à base d'acétate de médroxyprogestérone et de médrogestone
Depuis le 1er juillet 2024, de nouvelles règles de prescription et de délivrance entrent en vigueur pour les spécialités pharmaceutiques Depo Provera 150 mg/3 mL (acétate de médroxyprogestérone) et Colprone 5 mg (médrogestone). Ces mesures visent à mieux encadrer l’utilisation de ces médicaments en raison du risque de méningiome.
Pour toute nouvelle prescription à compter du 1er juillet 2024 :
- Traitement de moins d’un an : la prescription doit porter la mention “traitement inférieur à 1 an”. La délivrance peut se faire sans attestation d’information si cette mention est présente sur l’ordonnance.
- Traitement de plus d’un an : la délivrance nécessite la cosignature d’une attestation annuelle d’information par le prescripteur et la patiente.
Les pharmaciens devront vérifier que cette attestation est bien fournie pour les traitements renouvelés au-delà d’un an.
Application des nouvelles conditions pour les traitements en cours.
Les traitements en cours avant le 1er juillet 2024 doivent se conformer aux nouvelles conditions avant le 1er janvier 2025. Les pharmaciens doivent donc s’assurer que les patients apportent les documents requis lors de la délivrance après cette date.
Informations clés.
Depo Provera (acétate de médroxyprogestérone 150 mg/3 mL)
- Usage restreint : utilisation justifiée uniquement lorsque d’autres méthodes contraceptives ne sont pas possibles.
- Indications spécifiques : non-respect de l’observance, intolérance à l’implant sous-cutané ou au dispositif intra-utérin (DIU).
Colprone (médrogestone 5 mg)
- Indications en première intention : saignements liés aux fibromes, endométriose, mastodynie sévère.
- Non recommandé en première intention : ménopause, cycle artificiel avec œstrogène, irrégularités du cycle, syndrome prémenstruel, mastodynie non sévère.
Implication des pharmaciens
- Vérification des documents : assurez-vous que les patients fournissent l’attestation annuelle d’information cosignée pour les traitements de plus d’un an.
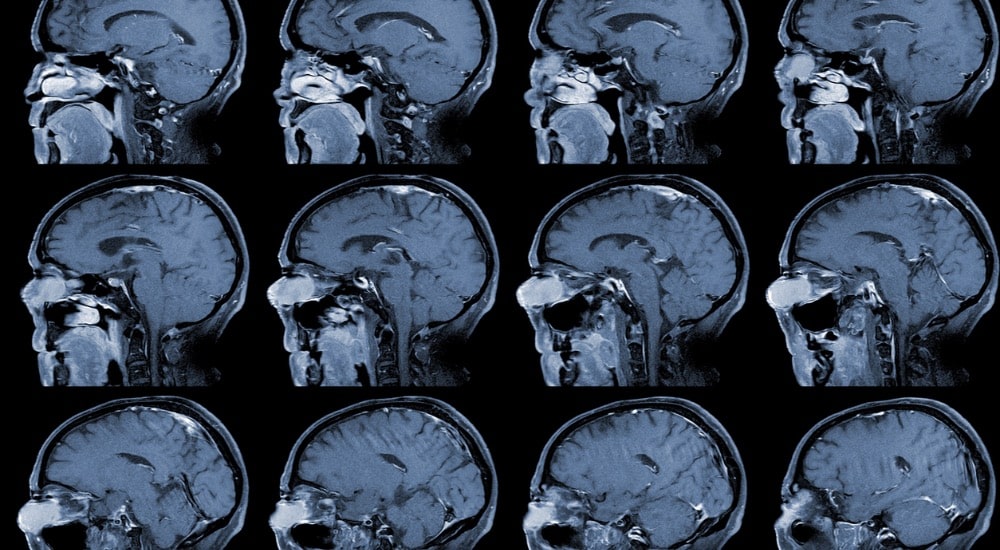
- Information des patients : rappelez aux patients l’importance de la surveillance par imagerie cérébrale (IRM) en lien avec les risques de méningiome.
- Délivrance responsable : limitez la délivrance des médicaments aux prescriptions conformes aux nouvelles régulations.
Surveillance par imagerie cérébrale (IRM)
- Initiale : réalisée à l’initiation du traitement en cas de facteurs de risque de méningiome.
- Pendant le traitement : en cas de signes évocateurs de méningiome.
- Suivi à long terme : IRM annuelle après un an de traitement, puis tous les 5 ans, et enfin tous les 2 ans si le traitement continue.